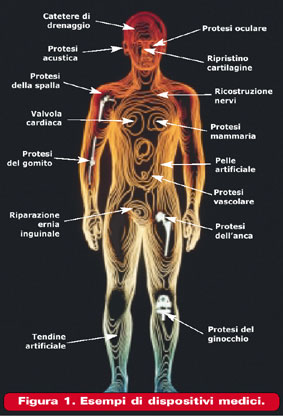
Biomateriali polimericiElena SalernitanoSi definisce biomateriale un materiale concepito per interfacciarsi con i sistemi biologici per valutare, dare supporto o sostituire un qualsiasi tessuto, organo o funzione del corpo (II International Consensus Conference on Biomaterials, Chester, Gran Bretagna, 1991). • diagnosi, prevenzione, controllo, terapia o attenuazione di una malattia; (Direttiva 93/42/CEE). I biomateriali hanno risposto al bisogno dell'uomo di sostituire od integrare tessuti ed organi, non più attivi dal punto di vista funzionale o metabolico, danneggiati da eventi patologici o traumatici, ed hanno coronato di successo una lunga serie di tentativi che risalgono agli albori della medicina. Il numero delle loro applicazioni è cresciuto notevolmente in questi anni e la portata delle innovazioni terapeutiche ha consentito ad un numero elevatissimo di pazienti la sopravvivenza o la restituzione di funzionalità a parti compromesse dell'organismo (Figura 1). Possono essere utilizzati sia in impianti permanenti o protesi, sia in dispositivi che sono a contatto con il corpo umano per un periodo di tempo limitato (ad esempio i dispositivi monouso utilizzati durante gli interventi chirurgici). Alcuni dispositivi medici possono essere utilizzati identicamente per qualsiasi paziente ne abbia necessità, altri invece devono essere realizzati per il singolo caso clinico, con forma, dimensioni e caratteristiche individuali; questo aumenta la difficoltà della progettazione e della scelta dei materiali. Le prestazioni dei materiali impiegati in campo medico sono valutate in base alla loro biofunzionalità e biocompatibilità. La biofunzionalità si riferisce alle proprietà che un dispositivo deve avere per riprodurre una determinata funzione dal punto di vista fisico e meccanico; la biocompatibilità, invece, alla capacità del dispositivo di continuare a svolgere quella determinata funzione durante tutta la vita utile dell'impianto ed è strettamente connessa, quindi, alle interazioni tra i biomateriali ed i tessuti con cui vengono a contatto. Vari studi hanno dimostrato che l'impiego di materiali inerti, che non innescano cioè alcuna reazione nell'organismo ospite né di rifiuto né di riconoscimento, non ha portato a buoni risultati. Nessun dispositivo che sia tollerato passivamente dall'organismo e non stimoli una incorporazione ed un riconoscimento, può assicurare la stabilità delle sue prestazioni nel lungo periodo. Gli studi più recenti sono pertanto rivolti all'impiego di materiali bioattivi. Le principali situazioni che richiedono l'applicazione di un dispositivo medico sono:
Le principali funzioni richieste ai biomateriali sono pertanto le seguenti.
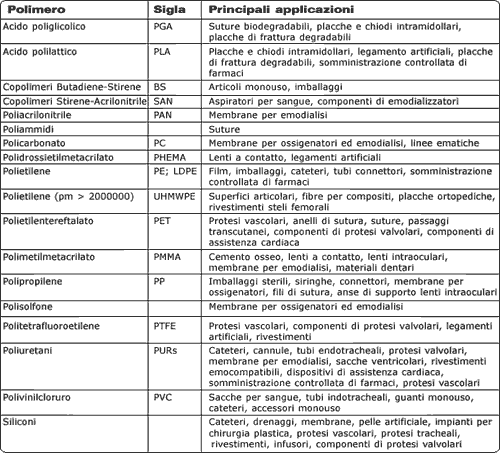
Nella maggior parte dei casi la funzionalità meccanica e fisica si riesce ad ottenere grazie all'utilizzo dei materiali disponibili dai primi anni '90. La causa principale dell'insuccesso clinico dei dispositivi medici risiede nella biocompatibilità. Le interazioni biomateriale-tessuto possono dar luogo a processi degradativi nei materiali ed a reazioni di intolleranza nell'organismo, specialmente per i componenti destinati ad operare per tempi lunghi in ambienti corrosivi e sotto l'azione di carichi ciclici. La biocompatibilità, inoltre, non è funzione solo delle caratteristiche e delle proprietà dei materiali (proprietà chimiche, rugosità, energia e carica superficiale, stabilità chimica, proprietà dei prodotti di degradazione, ecc.) e dei dispositivi impiantati (dimensioni, forma, rigidità, ecc.), ma anche delle condizioni dell'organismo ospite (tipo di tessuto, luogo di impianto, età, sesso, condizioni generali di salute, regime farmaceutico, ecc.) e della tecnica chirurgica. Lo stato di salute generale, infatti, influenza ad esempio i processi riparativi ed i meccanismi di difesa, la somministrazione di farmaci può avere effetti sui processi infiammatori. Due sono le caratteristiche principali che vanno considerate nella valutazione della biocompatibilità di un materiale: la resistenza del materiale ai processi di degradazione e gli effetti che i prodotti di tali processi hanno sui tessuti. La biocompatibilità di un materiale non va intesa comunque solo in riferimento alla sua sicurezza biologica, ma è relativa anche alle caratteristiche chimico-fisiche ed alle proprietà meccaniche del materiale e deve pertanto essere controllata durante l'intero ciclo produttivo, dalla fase di progettazione a quella di sterilizzazione, dall'approvvigionamento delle materie prime al confezionamento finale del prodotto. I fallimenti dei dispositivi impiantati possono essere ricondotti nella maggior parte dei casi a progetti e processi di lavorazione non adeguati, a tecniche chirurgiche improprie o ad un uso non appropriato dei materiali. I polimeri in medicinaNumerosi polimeri vengono attualmente impiegati nei dispositivi medici. I campi in cui trovano maggiore applicazione sono il controllo del flusso sanguigno e di altri fluidi corporei (cateteri, cannule, drenaggi, ecc.), le superfici articolari nelle protesi ortopediche, lenti a contatto ed intraoculari, membrane per la somministrazione di farmaci, rivestimenti per sensori e dispositivi elettronici impiantabili, rigenerazione tessutale, riempimento di cavità, valvole cardiache, protesi vascolari, organi bioartificiali (dispositivi medici in cui si ha combinazione di materiali sintetici e di cellule o tessuti viventi) (Tabella 1).
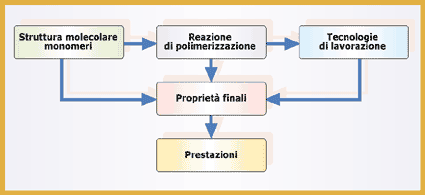
I principali vantaggi che i polimeri presentano rispetto alle altre classi di materiali sono una maggiore biocompatibilità, la possibilità di modificarne ampiamente composizione e proprietà fisico-meccaniche, bassi coefficienti di attrito, facile processabilità e lavorabilità anche in forme e strutture complesse, possibilità di modificarne chimicamente e/o fisicamente la superficie, possibilità di immobilizzare cellule o biomolecole al loro interno o sulla superficie. Gli svantaggi principali sono la presenza di sostanze che possono essere rilasciate nell'organismo (monomeri, catalizzatori, additivi, ecc.), la facilità di assorbimento di acqua e biomolecole dall'ambiente circostante (anche nelle applicazioni in cui non è richiesto), le basse proprietà meccaniche e, in alcuni casi, la difficoltà di sterilizzazione. Le proprietà finali del dispositivo dipendono sia dalla struttura molecolare intrinseca del polimero che dai processi chimici e fisici a cui è sottoposto e possono essere ampiamente manipolate intervenendo sulle condizioni operative di tali processi e sulla reazione di polimerizzazione (Figura 2).
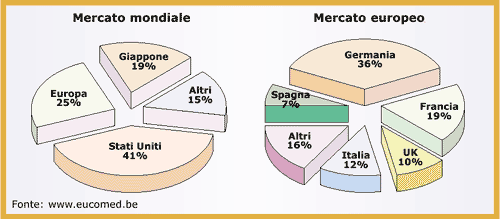
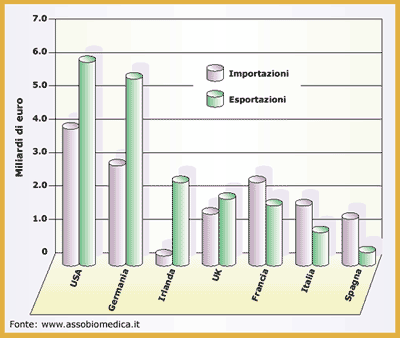
Vengono utilizzati sia polimeri naturali (ad esempio collagene, cellulosa), che artificiali (modificati chimicamente dall'uomo) e sintetici (ottenuti per sintesi chimica). La struttura, la composizione e le caratteristiche della zona superficiale del materiale polimerico impiantato, che si trova a diretto contatto con i fluidi ed i tessuti corporei, determinano la risposta biologica dell'organismo ospite perché sono responsabili della trasmissione delle sollecitazioni, dell'adesione, dell'attrito, dell'abrasione, della permeabilità a gas e a liquidi, della compatibilità con l'ambiente organico corrosivo circostante, ecc. Nella soluzione ottimale il materiale ed il tessuto dovrebbero interagire nel modo più appropriato possibile per massimizzare l'efficace incorporazione del materiale nel relativo tessuto e per assicurare, di conseguenza, la stabilità. Sono stati studiati, quindi, diversi metodi per modificare la superficie dei polimeri utilizzati in dispositivi medici per ottimizzarne le interazioni specifiche con i tessuti dell'organismo ospite, e quindi la biocompatibilità, ma lasciando inalterate le proprietà meccaniche e la funzionalità del dispositivo. Si possono, ad esempio, introdurre siti per l'immobilizzazione di specifiche cellule o biomolecole, creando superfici che ostacolino l'adsorbimento di determinate molecole, adsorbendo farmaci antinfiammatori o fattori di crescita che siano in grado di facilitare i processi di riparazione. Le modifiche superficiali possono essere raggruppate in due grandi categorie: modifiche che alterano chimicamente o fisicamente gli atomi o le molecole presenti sulla superficie, e rivestimenti della superficie con materiali di diversa composizione. Processi di biodegradazione dei polimeriIl corpo umano è un ambiente acquoso altamente aggressivo, la cui temperatura è stabilizzata a 37¡C ed il cui pH è mantenuto ad un valore medio pari a 7.4. I materiali impiantati sono soggetti a processi di degradazione sia passivi che attivi. La soluzione salina presente nel corpo umano è, infatti, un eccellente elettrolita che facilita i meccanismi di corrosione elettrochimica e di idrolisi. Nei tessuti, inoltre, sono presenti numerose molecole e cellule che hanno la capacità di catalizzare determinate reazioni chimiche o di isolare, attaccare e distruggere rapidamente i corpi estranei. La maggior parte dei polimeri utilizzati in dispositivi medici consente la diffusione dell'acqua all'interno della struttura molecolare e può quindi dar luogo a processi di idrolisi. La scelta di un polimero idrolizzabile-non idrolizzabile, oppure resistente-non resistente all'assorbimento di acqua è strettamente legata al tipo di applicazione considerata; è necessario, ad esempio, utilizzare un materiale facilmente degradabile per suture o dispositivi a rilascio controllato di farmaci. I processi degradativi dei materiali polimerici in vivo (biodegradazione) non sono semplicemente la conseguenza dell'assorbimento di acqua ma vanno considerati molti altri fattori che ne aumentano notevolmente la velocità in vivo. Numerose cellule, infatti, incluse quelle coinvolte nei processi infiammatori, producono enzimi che catalizzano alcune reazioni degradative con conseguente alterazione della struttura molecolare dei materiali impiantati. Alcune cellule specifiche (i fagociti), inoltre, migrano verso le zone coinvolte in fenomeni di irritazione ed infiammazione per la presenza di corpi impiantati, e si adsorbono sulla loro superficie riconosciuta come estranea da proteine (ad esempio anticorpi). Questo meccanismo ha come conseguenza un rapido aumento dell'attività metabolica di difesa dell'organismo ed è responsabile dell'attivazione di processi di degradazione dei materiali polimerici. I processi degradativi dei biomateriali variano in funzione della posizione dell'impianto all'interno dell'organismo, del tipo di tessuto con cui sono a contatto e da cui dipende la risposta del sistema immunitario, dalle caratteristiche fisiche e chimiche del materiale e dalle condizioni generali dell'organismo ospite (età, stato di salute, farmaci assunti, ecc.). Risposta dell'organismo ospiteLe reazioni del corpo umano come risposta all'impianto di un dispositivo medico hanno effetti sia nella zona di interfaccia che in zone più distanti. Nell'immediata vicinanza dell'impianto si verifica principalmente l'adsorbimento sulla superficie del dispositivo di proteine provenienti dal sangue che irrora i tessuti. Si riscontra una risposta dell'organismo anche a livello locale nella zona circostante il dispositivo impiantato. Tale risposta si articola in due fasi: inizialmente si sviluppa un'infiammazione perché la prima reazione del meccanismo di difesa dell'organismo ad un corpo estraneo è una modifica della struttura microvascolare e, quindi, della natura dei tessuti; successivamente si assiste ad un processo riparativo in cui i tessuti attivano determinati processi nel tentativo di risanare strutturalmente, e quando possibile funzionalmente, il danno. In generale se il materiale impiantato è tossico, questo provoca la necrosi del tessuto circostante; se non è tossico ed inerte dal punto di vista biologico si forma intorno all'impianto una capsula fibrosa (questa risposta è piuttosto rara perché solitamente il biomateriale non è completamente inerte); se, infine, il materiale è bioattivo, stimola una precisa risposta biologica e viene progressivamente integrato con il tessuto circostante. Nella maggior parte dei casi il materiale subisce una qualche forma di degradazione ed i prodotti di tale processo vengono rilasciati nei tessuti influenzando notevolmente i meccanismi di difesa dell'organismo e l'attività cellulare. Tali prodotti, se non sono biologicamente attivi e non sono tossici, vengono eliminati con i normali processi metabolici, se però la loro concentrazione raggiunge valori elevati possono accumularsi localmente o in organi bersaglio (milza, reni, linfonodi) e dare luogo a patologie acute o croniche. In caso, invece, di prodotti tossici, si sviluppa un'infiammazione persistente ed una interruzione dei processi riparativi fino ad arrivare, in alcuni casi, alla necrosi tessutale di alcune zone. I prodotti dei processi di degradazione, inoltre, possono restare confinati nella zona di rilascio, con effetti solo locali, o possono diffondere nel sistema vascolare ed avere così effetti anche su organi e tessuti lontani dalla zona di rilascio. Il mercato dei dispositivi mediciLa crescita ed il perfezionamento dei biomateriali è stata nell'ultimo ventennio considerevole e costante ed ha avuto importanti ricadute cliniche in tutte le discipline mediche ed in particolare in ortopedia, in chirurgia cardiovascolare ed in odontoiatria. Lo sviluppo e l'utilizzo di dispositivi sempre più complessi per la prevenzione, la diagnosi e la terapia è senza dubbio uno dei fattori di prolungamento e miglioramento della qualità della vita nei paesi occidentali. Per questo motivo la domanda di dispositivi medici sicuri ed efficaci è crescente e, di conseguenza, il loro mercato è in espansione. A causa della crescita di tale mercato la Comunità Europea ha avvertito l'esigenza di conformare i dispositivi medici dell'industria europea ad elevati standard di sicurezza. La direttiva 93/42/CEE dà la definizione di dispositivo medico e disciplina questo settore di prodotti ed è ripresa dalla legislazione italiana con normative che regolano il settore della produzione e del commercio dei dispositivi medici con lo scopo di tutelare la sicurezza e la salute dei consumatori e degli operatori. Il valore del mercato mondiale dei dispositivi medici è stato nel 2000 pari a 160 miliardi di euro. L'Europa è il secondo mercato in termini di fatturato dopo gli Stati Uniti (Figura 3). Il valore del mercato europeo dei dispositivi medici è stato nel 2000 pari a 39 miliardi di euro. Il mercato italiano dei prodotti medici è il terzo in Europa (Figura 3) e mostra un bilancio importazioni/esportazioni sfavorevole (Figura 4). Questo andamento è comune agli altri paesi europei, eccetto il Regno Unito. Nel settore dei dispositivi medici in Italia operano circa 700 imprese medio-piccole, principalmente situate nelle regioni settentrionali, e moltissime aziende artigianali soprattutto in ortopedia ed odontoiatria. Circa il 70% dei prodotti medici viene utilizzato nelle strutture ospedaliere, il restante 30% è impiegato a livello privato. |
Questo articolo è pubblicato sulla rivista NT Nuovi Tessili , consulta il sommario.