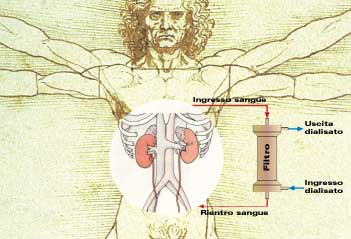
Dispositivi mediciElena SalernitanoI polimeri costituiscono la più ampia e diversificata classe di biomateriali attualmente impiegati nel settore dei dispositivi medici: vengono applicati nel settore degli organi artificiali, nel sistema cardiocircolatorio, in ortopedia, in oftalmologia, in odontoiatria, in chirurgia maxillofacciale, nei sistemi a rilascio controllato di farmaci, ecc. I materiali polimerici possono, infatti, essere rigidi, elastici, flessibili, cristallini, opachi, trasparenti... in base alla scelta del monomero di partenza, delle condizioni di polimerizzazione e del processo di lavorazione. Le caratteristiche del materiale da utilizzare per la costruzione di un dispositivo medico dipendono dalla specifica applicazione, dal tipo di sostanza o tessuti con cui deve venire a contatto e dal tempo di contatto. I dispositivi possono essere sia permanenti (protesi) e restare, quindi, in contatto con il corpo umano per tutta la vita del paziente, sia temporanei (ad esempio i dispositivi monouso utilizzati durante gli interventi chirurgici). Alcuni hanno, inoltre, forma, dimensioni e proprietà compatibili con qualsiasi caso clinico, altri devono essere realizzati con caratteristiche specifiche per il paziente che ne abbia necessità. Vediamo in dettaglio le principali applicazioni dei materiali polimerici in medicina. Rene artificialeLa possibilità di mantenere in vita pazienti in cui la funzione renale è insufficiente o completamente compromessa rappresenta uno dei più grandi progressi della medicina. La funzione che deve esplicare un rene artificiale è quella di mantenere l'omeostasi corporea, cioè fare in modo che ogni sostanza venga mantenuta al corretto valore di concentrazione. L'emodialisi extracorporea è la metodica dialitica principalmente impiegata per la rimozione dei rifiuti metabolici dal circuito ematico e dell'acqua accumulatasi nell'organismo. L'apparecchiatura utilizzata è comunemente denominata rene artificiale. Il sangue proveniente dal paziente arriva al filtro dializzatore per mezzo della linea arteriosa e ritorna depurato al paziente, dopo aver attraversato il filtro, lungo la linea venosa (Figura 1).
I dializzatori più frequentemente impiegati sono quelli a fibre cave. Queste ultime sono fissate su due piastre di poliuretano e l'intero modulo è inserito in una cartuccia di policarbonato (Figura 2).
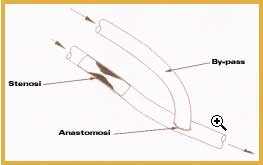
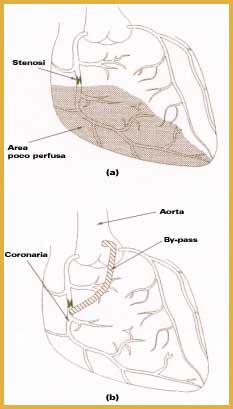
Le fibre separano due compartimenti (lo spazio all'interno delle fibre e quello che circonda le fibre all'interno della cartuccia) nei quali circolano in senso inverso il sangue ed il liquido di dialisi; sono realizzate con una membrana che deve essere permeabile ai metaboliti da rimuovere ed all'acqua, impermeabile alle proteine ed ai composti necessari all'organismo, deve possedere adeguata resistenza meccanica, buona emocompatibilità per minimizzare la formazione di trombi ed i fenomeni di emolisi, non deve rilasciare sostanze tossiche, cancerogene o contaminanti nel sangue, ed attivare le reazioni del sistema immunitario. Le membrane utilizzate possono essere distinte in tre categorie: quelle di cellulosa, di polimeri derivati dalla cellulosa e quelle sintetiche (soprattutto polisolfone, policarbonato e poliacrilonitrile). Le reazioni di incompatibilità verso i materiali impiegati nei dializzatori possono essere influenzate dal processo di sterilizzazione impiegato e dalla presenza di plastificanti. Alcuni residui della sterilizzazione possono, infatti, rimanere legati ai materiali a contatto con il sangue ed essere rilasciati nella corrente sanguigna con effetti negativi; inoltre i plastificanti aggiunti al materiale polimerico per migliorarne le prestazioni possono migrare nel sangue del paziente. Pancreas artificialeIl pancreas ha la funzione endocrina di controllare la concentrazione di glucosio nel sangue attraverso la secrezione di insulina. Nei pazienti diabetici tale funzione è compromessa e, di conseguenza, il livello di glucosio aumenta oltre il normale valore. Un controllo grossolano di tale concentrazione si ottiene attraverso la frequente somministrazione di insulina mediante iniezioni. Tale metodologia, però, può dar luogo a complicanze a lungo termine come cecità, problemi cardiaci ed epatici. Sono state quindi studiate varie strategie per ottenere un controllo migliore e più accurato della glicemia. Vengono comunemente utilizzate in pazienti diabetici pompe impiantabili che rilasciano insulina; l'involucro esterno è generalmente ricoperto di silicone, per altre parti si utilizzano politetrafluoroetilene e polipropilene. Le maggiori complicazioni sono dovute ad ostruzioni del catetere in seguito all'adesione dei tessuti del paziente. Un'altra metodologia è rappresentata da matrici polimeriche a rilascio controllato di insulina, come ad esempio il vinilacetato di etilene (eva), che hanno però il limite di non poter essere ricaricate dopo l'uso. Numerosi studi e ricerche sono rivolti alla realizzazione ed ottimizzazione di un pancreas bioartificiale costituito da una membrana semipermeabile che contenga al suo interno un tessuto che secerne insulina, generalmente le isole di Langerhans, e che ha lo scopo di non porlo direttamente in contatto con i tessuti dell'organismo ospite per evitare reazioni del sistema immunitario e conseguente rigetto. Fegato artificialeIl trapianto del fegato è l'unica forma effettiva di terapia attualmente disponibile per i pazienti con gravi insufficienze epatiche. Le liste di attesa sono però molto lunghe e la mortalità rimane elevata. Il trapianto può inoltre risultare non necessario in pazienti che mostrano un'attiva rigenerazione epatica. Un'apparecchiatura di supporto extracorporea può migliorare le condizioni cliniche preoperatorie dei pazienti che necessitano di un trapianto e può evitarlo nei pazienti in grado di rigenerare un numero di epatociti (cellule epatiche) sufficiente a mantenere la funzionalità epatica. I sistemi meccanici di detossicazione del sangue non riescono a riprodurre le molteplici funzioni metaboliche e di sintesi del fegato. La ricerca è quindi rivolta allo sviluppo di sistemi biologici che fanno uso di epatociti sia impiantati direttamente nel paziente (ad esempio nella milza o nella cavità addominale) sia extracorporei. Questi ultimi sembrano i più promettenti e sono costituiti da una componente biologica (epatociti di mammiferi), da un bioreattore a fibre cave e dal circuito del plasma o del sangue (più frequentemente plasma per evitare la somministrazione di farmaci antitrombotici che aumenta il rischio del trattamento). In uno dei due compartimenti del bioreattore vengono immobilizzati gli epatociti e viene fatta circolare una corrente ricca di nutrienti per mantenerli vitali, nell'altro circola il plasma-sangue del paziente. La membrana ha lo scopo di non porre gli epatociti in diretto contatto con il plasma-sangue del paziente per non stimolare reazioni immunitarie. I metaboliti tossici diffondono dal plasma-sangue del paziente attraverso la membrana delle fibre e sono detossicati dagli epatociti intrappolati. Il circuito è analogo a quello dell'emodialisi extracorporea. La capacità di detossicazione viene incrementata aggiungendo nel circuito del plasma-sangue, prima del bioreattore, una preliminare purificazione meccanica (ad esempio una colonna con carbone attivo) ed un ossigenatore. In questo modo gli epatociti vengono protetti dai possibili effetti tossici del plasma-sangue del paziente affetto da insufficienza epatica e viene assicurato un adeguato rifornimento di ossigeno per il mantenimento della loro vitalità ed attività funzionale. Normalmente le fibre cave sono realizzate con polisolfone perché presenta buona biocompatibilità dando minima attivazione cellulare, minimo rilascio di prodotti cellulari, minima attivazione della coagulazione. Dispositivi cardiovascolariLe insufficienze cardiocircolatorie sono tra le principali cause di mortalità. Diversi tipi di lesioni, congenite o acquisite, coinvolgono il cuore ed i vasi sanguigni dando luogo a gravi insufficienze funzionali che richiedono interventi chirurgici. I dispositivi cardiovascolari sono sussidi terapeutici impiegati nel sistema cardiaco o nei vasi sanguigni umani. I materiali impiegati devono essere emocompatibili, devono cioè poter restare in contatto con la corrente sanguigna per tempi prolungati senza provocare reazioni di intolleranza, senza rilasciare sostanze, senza subire modifiche o alterazioni, senza danneggiare i costituenti del sangue e senza dar luogo a fenomeni trombogenici con conseguente rischio di occlusione vascolare o tromboembolia. L'insorgenza di fenomeni coagulativi è il problema fondamentale per i materiali che devono venire in contatto con il sangue. La realizzazione di un materiale perfettamente emocompatibile è ancora oggi un problema aperto malgrado il notevole sforzo di ricerca. L'emocompatibità è, infatti, una caratteristica che dipende da numerosi fattori quali, ad esempio, il luogo dove viene impiantato il dispositivo, la funzione che deve svolgere, la durata dell'impianto, l'emodinamica della zona in esame, le caratteristiche morfologiche, chimiche e fisiche della superficie. Un materiale può, pertanto, risultare emocompatibile per un'applicazione ma non per un'altra. Il principale settore di applicazione dei polimeri è quello relativo agli innesti vascolari. Questi ultimi sono dispositivi medici che vengono impiantati permanentemente per ripristinare l'efficacia di un tratto vascolare che, per qualsiasi motivo, non sia più in grado di trasportare correttamente il sangue. Devono presentare elevata elasticità per consentire una normale dinamica circolatoria, adeguata flessibilità per l'adattamento alle esigenze anatomiche, buona stabilità, non devono innescare il meccanismo della coagulazione del sangue che porterebbe all'ostruzione del lume protesico, devono consentire un'incorporazione graduale della protesi in un tessuto cicatriziale, la cui crescita controllata deve consentire la ricostruzione della parete vasale senza invadere il lume protesico. Gli impianti più critici sono quelli relativi a vasi di piccolo diametro (4-6 millimetri al massimo) perché sono maggiormente esposti a rischi di trombosi conseguenti al lento fluire del sangue al loro interno. I materiali devono, inoltre, essere facilmente maneggiabili per consentire un efficiente adattamento chirurgico che opponga la minore resistenza possibile al flusso del sangue. Vengono utilizzate materie plastiche in forma di tessuto a cui il sangue, coagulando, conferisce la necessaria impermeabilità. I materiali più idonei sono il polietilentereftalato, il politetrafluoroetilene espanso e vari poliuretani. Le principali applicazioni sono la sostituzione di tratti vasali con protesi di forma e dimensioni corrispondenti; il congiungimento, attraverso la tecnica del by-pass, di due punti di un'arteria a monte e a valle di una lesione o di un restringimento del diametro (stenosi) (Figure 3 e 4);
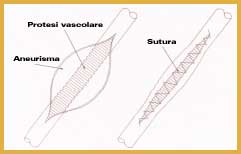
l'inserimento di una protesi all'interno di un aneurisma (allargamento di un'arteria causato dal cedimento progressivo della parete vascolare) (Figura 5).
La ricerca è rivolta alla sintesi di materiali bioartificiali, materiali cioè in cui si combinino una fase sintetica e cellule viventi. I più recenti studi sono relativi alla possibilità di colonizzare la superficie interna con cellule endoteliali per creare un nuovo tessuto endoteliale in sostituzione di quello compromesso con relative proprietà anticoagulanti. La più semplice soluzione di questo genere è la combinazione di albumina e collagene in matrici di poliestere. Materiali polimerici vengono impiegati anche nelle valvole cardiache, nei dispositivi di assistenza cardiaca e negli stimolatori cardiaci (pacemaker) principalmente come incapsulanti e per gli anelli di sutura (soprattutto siliconi, poliuretani, polietilentereftalato, politetrafluoroetilene e resine epossidiche). Protesi ortopedicheLe cause che possono rendere necessario l'impianto di una protesi ortopedica sono molteplici: artrosi, cioè la degenerazione delle cartilagini articolari, eventi traumatici, patologie legate all'invecchiamento, come l'osteoporosi, cancro osseo e necrosi del tessuto osseo. Le protesi ortopediche, di solito preposte a funzioni di sostegno, vengono distinte in protesi minori (chiodi e placche endomidollari per la fissazione delle fratture, viti, nastri, fili), preposte al consolidamento di parti deboli, e protesi maggiori destinate a sostituire capi articolari, diafisi di ossa lunghe, intere ossa corte, porzioni di scatola cranica o di bacino (Figura 6).
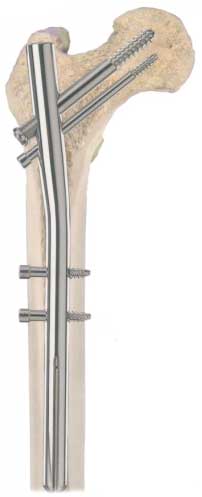
Uno dei principali obiettivi della progettazione di una protesi ortopedica è quello di fare in modo che il tessuto osseo dell'organismo ospite dopo l'impianto sia sottoposto a sollecitazioni il più simili possibile a quelle fisiologiche allo scopo di conservare l'integrità e la funzionalità dell'osso e del materiale protesico durante tutta la vita del paziente. L'integrità dell'interfaccia osso-impianto dipende da numerosi fattori: il tipo, l'entità e la distribuzione delle sollecitazioni, la modifica dell'anatomia tessutale, la reazione tessutale ai materiali impiantati, i traumi riportati durante l'intervento chirurgico, il movimento relativo tra l'osso e l'impianto che impedisce la formazione di nuovo tessuto osseo, l'attrito nel movimento articolare, la finitura superficiale dell'impianto, la preparazione del tessuto osseo prima dell'intervento, la tecnica chirurgica utilizzata. Tutti questi fattori sono responsabili del successo e della stabilità a lungo termine dell'impianto. Facendo riferimento alla protesi dell'anca (Figure 7 e 8),
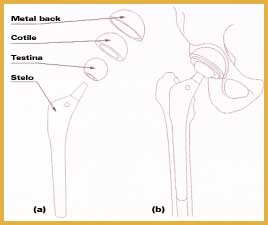
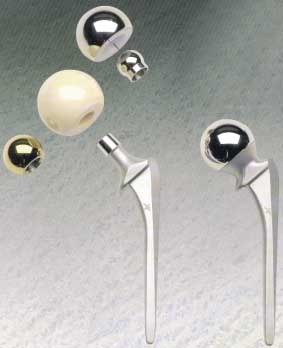
che è quella maggiormente impiantata e su cui si sono ottenuti per il momento i risultati migliori, le sollecitazioni a cui è sottoposta possono raggiungere valori molto elevati (fino a 5-7 volte il peso corporeo) e la progettazione deve anche tener conto del limite a fatica della struttura perché durante il ciclo del passo l'apparato locomotore è sottoposto a carichi ciclici la cui entità dipende dal tipo di attività svolta (camminare, correre, salire o scendere scale, ecc.). Una protesi di anca può essere cementata o meno, può cioè essere stabilizzata da un agente legante o può esserci diretto contatto tra i tessuti e la superficie dell'impianto. Lo stelo femorale è fissato nel canale midollare del femore e la testa femorale si articola in un acetabolo che ha la funzione di ridurre l'attrito. La trasmissione delle sollecitazioni al femore è funzione dei materiali impiantati e dell'interfaccia sia tra i diversi materiali che tra i materiali ed i tessuti dell'organismo ospite. Il principale fattore limitante la durata dell'impianto è il rilascio di notevoli quantitativi di detriti di usura dalle superfici direttamente coinvolte nel movimento articolare, che determina la reazione immunitaria dell'organismo ospite con conseguente infiammazione, riassorbimento del tessuto osseo e perdita di stabilità della protesi. L'usura dipende da proprietà fisico-chimiche dei materiali e della loro superficie, da fattori legati al paziente, come età, sesso, peso, condizioni generali di salute, tipo di attività, e dalla tecnica chirurgica. Altro fattore limitante è l'alterazione della distribuzione fisiologica dei carichi nel tessuto osseo che può determinare il riassorbimento osseo causando la mobilizzazione della protesi. I polimeri nelle protesi ortopediche vengono impiegati come elementi di collegamento nelle articolazioni. Il più utilizzato in questo ambito è il polietilene ad altissimo peso molecolare. I due principali fattori limitanti sono la bassa resistenza allo scorrimento plastico ed all'usura che condiziona il comportamento a fatica. Ulteriore problema è l'utilizzo, nei processi di polimerizzazione del polietilene, di catalizzatori contenenti titanio ed alluminio che restano in tracce nel polimero e vengono successivamente rilasciati nei tessuti dell'organismo ospite stimolando reazioni che contribuiscono al distacco della protesi. Nel caso di protesi cementate l'agente legante (cemento osseo) è polimerico. Viene impiegato principalmente polimetilmetacrilato; la proprietà meccanica più critica è la resistenza a fatica. I materiali polimerici sono impiegati anche come rivestimento per steli metallici al fine di produrre una protesi con modulo elastico più simile a quello del tessuto osseo e consentire, quindi, una migliore distribuzione degli sforzi riducendo le reazioni tessutali. La ricerca è orientata all'impiego di materiali polimerici porosi (politetrafluoroetilene, polisolfone, polietilene) con la funzione di stimolare e favorire l'osteointegrazione dell'impianto consentendo la crescita di nuovo tessuto osseo all'interno dei pori. Materiali polimerici biodegradabili e bioriassorbibili, in genere a base di acido polilattico e poliglicolico, vengono utilizzati nella realizzazione di placche e chiodi endomidollari (Figura 9)
per il consolidamento di fratture non troppo sollecitate; una volta esaurita la loro funzione stabilizzante delle ossa fratturate, invece di essere rimossi, vengono riassorbiti ed eliminati dall'organismo ospite. I materiali polimerici trovano applicazione anche nel ripristino di legamenti, soprattutto i crociati del ginocchio. Vengono impiegati, a questo scopo, principalmente polimeri dell'acido lattico come rivestimento di fibre di carbonio per favorire la crescita di nuovo tessuto che sostituisca tale rivestimento polimerico, il politetrafluoroetilene ed il polidrossietilmetacrilato. Applicazioni in oftalmologiaL'apparato oculare è costituito da un insieme di strutture che nel loro complesso ed in diversa misura contribuiscono alla sensazione visiva. I due principali usi dei biomateriali in oftalmologia riguardano le lenti a contatto e le lenti intraoculari per la correzione di difetti visivi o per far fronte ad eventi traumatici. Lenti a contattoLa scelta del materiale e la progettazione devono essere mirate all'ottenimento di buone proprietà ottiche, adeguate bagnabilità e proprietà meccaniche, alta permeabilità ai gas (deve essere garantita la corretta ossigenazione della cornea che è un tessuto privo di apporto di sangue e quindi non direttamente irrorato), resistenza alla degradazione, facilità di lavorazione e resistenza alla contaminazione. La biocompatibilità non è un fattore critico perché, sebbene la cornea sia un tessuto sensibile, non essendo presenti capillari sanguigni, la risposta immunitaria è diversa da quella di altri tessuti. La lente deve, però, lasciare intatto e non interferire con il film di lacrime che bagna continuamente la cornea. Le lenti a contatto non sono soggette a grandi sollecitazioni ma devono essere facilmente maneggiabili. Tutti i materiali utilizzati sono polimerici e vengono divisi in rigidi e morbidi. Una lente si definisce morbida se si conforma con la superficie del bulbo oculare, rigida in caso contrario. La quasi totalità delle lenti a contatto attualmente applicate è del tipo morbido in idrogel o rigido gas-permeabile. Le lenti a contatto morbide costruite in idrogel sono notevolmente diffuse per la tollerabilità elevata anche nei primi momenti di adattamento e per la buona gas-permeabilità. I polimeri idrogel interagiscono però più facilmente, rispetto ad altri materiali, con elementi che compongono le lacrime e che vanno poi a formare i depositi superficiali. L'idrogel principalmente utilizzato è il poliidrossietilmetacrilato. Esistono anche lenti morbide gommose che sono costituite da silicone, polimetilsilossano o suoi copolimeri, fluoropolimeri. Presentano buona flessibilità ed elevata permeabilità all'ossigeno ma sono fortemente idrofobe e questo è causa di fastidio per i pazienti. Le lenti rigide gas-permeabili sono costituite principalmente da copolimeri di alcuni siliconi. La maggior parte delle lenti rigide ha un'estensione inferiore a quella della superficie corneale, le lenti morbide hanno invece dimensioni maggiori della superficie corneale. Tale fattore, associato all'estrema flessibilità, rende queste ultime estremamente confortevoli e con ridotte probabilità di fuoriuscita occasionale dall'occhio, hanno però lo svantaggio di essere più fragili e di accumulare facilmente depositi; la verifica dei parametri costruttivi è inoltre più complessa in confronto alle lenti rigide. Lenti intraoculariOltre alle lenti a contatto i polimeri trovano applicazione in oftalmologia anche nelle lenti intraoculari che vengono impiantate in seguito a cataratta (qualsiasi opacità del cristallino, da una modesta e localizzata perdita di trasparenza fino all'opacamento). Quando non è possibile fermarne l'evoluzione o farla regredire con sostanze anticarattogene, si interviene chirurgicamente mediante estrazione della stessa ed inserimento di un cristallino artificiale. Le lenti intraoculari (IOL), o cristallini artificiali, più comunemente utilizzate sono costituite da un corpo ottico centrale in polimetilmetacrilato e da due anse di supporto di forma arcuata in polipropilene o, più frequentemente polimetilmetacrilato. Una lente posizionata correttamente rimane stabile e non crea problemi di tolleranza. La funzione visiva è recuperata quasi immediatamente e la percentuale di complicanze è estremamente ridotta. Protesi ed impianti dentaliI polimeri vengono impiegati in odontoiatria per la realizzazione di elementi di dentiere, denti artificiali, otturazioni, adesivi e materiali da impronta. I materiali utilizzati devono rispondere a requisiti chimici, fisici e biologici; devono, cioè, essere compatibili con i tessuti dell'organismo ospite, non attivare le reazioni del sistema immunitario, trasmettere le sollecitazioni in maniera adeguata e non degradarsi nell'ambiente corrosivo della cavità orale. In molti casi, inoltre, devono poter riprodurre l'aspetto estetico dei tessuti naturali sia per quanto riguarda il colore che la lucentezza. In caso di sostituzione di uno o più denti mancanti si utilizzano protesi che possono essere fisse (ponti) o mobili, parziali o totali e devono, in ogni caso, ripristinare la funzione masticatoria, fonetica ed estetica. Sempre più frequentemente vengono impiegati anche gli impianti dentali che sono costituiti da una componente endossea, in forma di vite o perno, da un elemento transgengivale, che deve impedire ai batteri del cavo orale l'accesso all'interfaccia osso-impianto, e dal moncone su cui eseguire l'intervento di ricostruzione funzionale ed estetico (Figura 10).
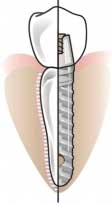
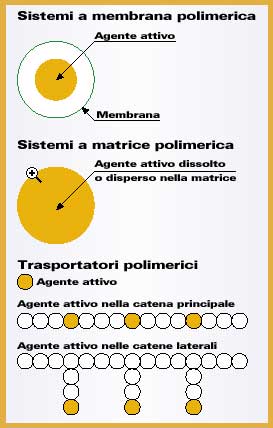
La componente endossea deve poter essere osteointegrata, deve cioè stabilirsi un'interconnessione diretta strutturale e funzionale tra l'osso vitale e la superficie dell'impianto sottoposto a carico. Il polimero più largamente impiegato in odontoiatria è il polimetilmetacrilato o suoi copolimeri per l'eccellente biocompatibilità, perché possono essere prodotti utilizzando tecniche semplici, presentano buona lucentezza, possono essere tinti per uniformarsi all'aspetto estetico dei tessuti orali ed hanno un basso peso specifico che è un vantaggio soprattutto nelle protesi mobili. Vengono utilizzati soprattutto per la ricostruzione di denti mancanti e, nelle protesi mobili, per la parte a contatto con la gengiva. Polisolfone e siliconi vengono utilizzati come materiale da impronta per lo studio delle diverse componenti del sistema dentario e per realizzare calchi per elementi protesici. Poliuretani e resine acriliche sono impiegati come adesivi dentinali per isolare dall'attacco batterico la zona in cui viene effettuata un'incisione. Politetrafluoroetilene, acido polilattico e copolimeri acido polilattico-poliglicolico sono impiegati nella rigenerazione del parodonto (apparato di sostegno del dente). Chirurgia maxillofaccialeIl successo degli interventi di chirurgia maxillofacciale dipende in gran parte dalla risposta dei tessuti, in particolare del tessuto osseo della mascella e della mandibola e dell'epitelio della mucosa orale. Tale chirurgia ricostruttiva è utilizzata principalmente in caso di sostituzione o ricostruzione dell'articolazione temporomandibolare, per ripristino di tessuti asportati, sia duri che morbidi, e per interventi in seguito a fratture delle ossa facciali o difetti congeniti od acquisiti. Gli interventi di chirurgia maxillofacciale sono necessari soprattutto in pazienti affetti da artrite dell'articolazione temporomandibolare, cioè tra la mandibola e la restante parte del cranio, con conseguente dolore, infragilimento e gonfiore. Tale sistema è una delle articolazioni più complesse del corpo umano. La soluzione che sembra dare migliori risultati è costituita da una testa sferica metallica che ruota all'interno di un seggio di polietilene ad altissimo peso molecolare (simile alla protesi di anca). La principale causa di insuccesso a lungo termine è l'usura, ed il materiale ottimale non è ancora stato trovato. Sono tuttora in fase di studio anche gli impianti per il ripristino parziale o totale della mandibola, dei linfonodi della testa e del collo ed altri tessuti morbidi che vengono asportati a causa di tumori. Tali tessuti sono responsabili della distribuzione delle forze nella masticazione e della protezione di organi vitali. Non è possibile impiantare tessuti autogeni perché vengono alterati dai trattamenti chemioterapici. Gli studi attuali sono rivolti a supporti metallici e reti metalliche o polimeriche. Nei pazienti che riportano fratture delle ossa facciali si impiantano placche di titanio o acciaio inossidabile, simili a quelle utilizzate in ortopedia. Tali placche devono, però, essere rimosse chirurgicamente una volta che l'osso si è saldato per evitare che diano complicanze. Si sta perciò studiando l'impiego di placche di frattura degradabili (copolimeri acido poliglicolico-acido polilattico). Somministrazione controllata di farmaciIl rilascio di farmaci o agenti attivi in maniera controllata presenta notevoli vantaggi rispetto ai metodi tradizionali, consistenti nella somministrazione a tempi predefiniti della dose prescritta. Consente, infatti, la somministrazione ad un tessuto od organo bersaglio, in un preciso istante, della quantità di farmaco necessaria, aumentandone l'efficacia e riducendone gli effetti collaterali, oppure permette di mantenere la concentrazione del farmaco nell'organismo ad un livello predeterminato con variazioni minime della concentrazione. Con i sistemi tradizionali, infatti, dopo che un farmaco od un agente attivo è stato ingerito od iniettato, la sua concentrazione nel paziente aumenta, raggiunge un picco e poi diminuisce. Dato che ogni sostanza terapeutica presenta un intervallo di concentrazione superato il quale diventa tossica e sotto cui la sua azione non è efficace, ad andamenti oscillatori della concentrazione corrispondono intervalli di tossicità ed inefficacia. Nei sistemi per il rilascio controllato di farmaci vengono utilizzati esclusivamente materiali polimerici. Dal momento che questi ultimi sono direttamente in contatto con l'ambiente biologico in cui sono iniettati, impiantati o inseriti, la loro tossicità, biocompatibilità ed immunogenicità sono fattori critici. Nei sistemi biodegradabili, ad esempio, tutti i prodotti della degradazione polimerica non devono essere tossici, cancerogeni e devono poter essere eliminati per evitare il loro eccessivo accumulo all'interno dei tessuti. I dispositivi possono essere raggruppati in tre categorie in base al meccanismo di rilascio. Dispositivi a membrana polimerica (Figura 11)L'agente attivo costituisce un nucleo all'interno di una membrana inerte. è contenuto all'interno a concentrazioni molto elevate e diffonde attraverso la membrana mosso da un gradiente di concentrazione. Il rilascio può avvenire per diffusione attraverso il polimero stesso, per diffusione attraverso pori, per erosione del polimero, per osmosi o secondo combinazione di meccanismi diversi in funzione del tipo di membrana utilizzata (compatta, microporosa, microcapsule, ecc.). I dispositivi di questa categoria vengono in genere impiantati negli interstizi, nelle cavità corporee (ad esempio utero e vagina), nel tessuto adiposo, intramuscolarmente, oppure vengono somministrati per via orale o iniettati in vena. Fanno parte di questa categoria anche i dispositivi transdermici (cerotti). Dispositivi a matrice polimerica (Figura 11)L'agente attivo è disperso o dissolto all'interno del polimero. Con matrici polimeriche non porose il rilascio avviene per diffusione a cominciare dagli strati superficiali e, solo successivamente, dalle regioni più interne per le quali sono necessari tempi più lunghi. Con membrane porose il rilascio avviene, invece, attraverso la porosità ed è funzione delle dimensioni molecolari, della tortuosità dei microcanali e della frazione volumetrica dei pori. Vengono in genere utilizzate matrici polimeriche racchiuse da membrane o matrici biodegradabili (polimeri che subiscono idrolisi dei legami covalenti o bioerosione in assenza di idrolisi). I dispositivi che rientrano in questa categoria vengono, nella maggior parte dei casi, iniettati nei fluidi corporei o ingeriti Trasportatori polimerici (Figura 11)Nei sistemi di trasporto in cui molecole polimeriche agiscono da veicolo per l'agente attivo, questo può essere inserito nella catena polimerica principale durante il processo di polimerizzazione in posizioni precise o casuali, oppure può essere incorporato in una catena polimerica già costituita reagendo con i gruppi chimici terminali della catena principale o con quelli delle catene laterali. L'azione farmaceutica risulta più lunga di quella dei sistemi di somministrazione tradizionali perché, quando il farmaco è inserito in una catena polimerica, aumenta la resistenza al trasporto nelle varie regioni dell'organismo, la rottura dei legami tra farmaco e polimero è un processo lento e la possibilità di escrezione è più bassa. A causa della difficoltà di trasporto nelle diverse zone dell'organismo, sono generalmente introdotti direttamente nella zona in cui è necessaria la somministrazione del farmaco. Vengono in genere impiegati nella chemioterapia allo scopo di ridurre la tossicità dell'agente attivo e di aumentarne la selettività nei confronti delle cellule tumorali. I materiali principalmente utilizzati nei dispositivi a matrice polimerica sono il polidimetilsilossano, il polietilene, il polivinilacetato di etilene, il polivinilalcol ed i poliuretani. Nei dispositivi con matrici o membrane biodegradabili il meccanismo di rilascio può essere diffusivo, degradativo o una combinazione dei due. In ogni caso si verifica la solubilizzazione di porzioni di matrice o membrana, vengono perciò impiegati polimeri solubili in acqua o insolubili ma resi solubili in seguito alla rottura idrolitica di alcuni legami della catena. I materiali più frequentemente impiegati sono polimeri dell'acido glicolico, polimeri dell'acido lattico, copolimeri di acido lattico e acido glicolico ed idrogel. I materiali polimerici impiegati come trasportatori nei sistemi in cui l'agente attivo è incorporato nella catena polimerica sono maggiormente polisaccaridi, albumina, anticorpi, acido poliglutammico, acido poliaspartico, acido polimaleico e polietilenglicoli.
Sviluppi futuriSi possono individuare principalmente tre settori di ricerca.
In ogni campo di ricerca ed applicazione va comunque tenuto presente che si potranno ottenere miglioramenti e successi solamente attraverso una continua collaborazione ed un costante scambio di competenze tra discipline diverse: scienza dei materiali per quanto riguarda processi di lavorazione, forma, struttura, proprietà, ecc.; meccanica per lo studio delle proprietà di resistenza, tenacità, durezza, comportamento a fatica, ecc.; chimica in relazione ai fenomeni di corrosione, rilascio di ioni, adesione ai tessuti circostanti, proprietà superficiali, ecc.; biologia per lo studio della crescita cellulare, dei processi di cicatrizzazione, del rimodellamento dei tessuti, della risposta biologica, ecc.; medicina per quanto riguarda la risposta dell'organismo ospite, le tecniche chirurgiche, i rischi dell'intervento, l'eventuale necessità di somministrazione di farmaci, ecc. |
||||
Questo articolo è pubblicato sulla rivista NT Nuovi Tessili , consulta il sommario. |